Newsletter Groupe Rythmologie – Stimulation cardiaque de la SFC
Chers collègues,
Dans la newsletter de ce mois-ci, vous retrouverez l’actualité consacrée au récent congrès Européen EHRA 2021 avec, entre autres, les résumés des grandes études et une partie des nouvelles recommandations pour la stimulation cardiaque, et la rubrique histoire et témoignage.
Bonne lecture !
Laurent Fauchier et Jérôme Taieb
CONGRES EHRA 2021
Le Congres EHRA a eu lieu du 23 au 25 avril en format purement digital et a accueilli 3500 participants. La newsletter du groupe de rythmologie vous en offre un résumé.
- Mise à jour du guide pratique EHRA des AOD pour les patients avec fibrillation atriale
- Fauchier, CHU Tours
Le guide pratique de l’EHRA 2021 sur l’utilisation des anticoagulants oraux directs (AOD), chez les patients avec fibrillation atriale (FA) en est à sa quatrième édition.1 Depuis sa première version en 2013, ce guide fait souvent office de référence. Le guide pratique EHRA complète les recommandations ESC en donnant des conseils sur la façon d’utiliser les AOD dans plusieurs situations cliniques spécifiques.
Les informations sur les interactions médicamenteuses ont été mises à jour avec une nouvelle section sur les médicaments à base de plantes les plus couramment utilisés. Le millepertuis peut en particulier réduire les taux circulants d’AOD et augmenter le risque d’AVC. Les auteurs mettent donc fortement en garde contre l’utilisation simultanée des AOD et du millepertuis.
Des zones d’incertitude persistent concernant l’interruption ou non des AOD lors de procédures interventionnelles et pour la gestion péri-opératoire des AOD. Le document illustre pour différentes procédures quand prendre la dernière dose avant l’intervention et le délai de reprise au décours. Pour de nombreuses interventions mineures, il est possible de ne pas interrompre les AOD, alors que les interventions plus invasives nécessitent une interruption. Les très rares situations à haut risque dans lesquelles un relais peut être discuté sont les chirurgies avec un risque hémorragique élevé chez les patients ayant eu un événement thromboembolique récent (<3mois) ou ayant subi un événement lors d’une précédente interruption du traitement par AOD.
Une section est consacrée aux patients fragiles et âgés qui ont simultanément des risques élevés d’AVC, de saignement et de sous-traitement. Des indications sont données sur la manière d’évaluer le niveau de fragilité. La plupart des patients avec FA bénéficient des AOD, mais chez ceux qui présentent ont une fragilité très importante, les risques peuvent l’emporter sur les avantages. Pour les malades dépendants ou en fin de vie, le bénéfice des AOD parait ainsi modeste.
De nouvelles sections ont aussi été ajoutées pour l’utilisation des AOD chez les personnes avec un poids élevé ou faible, chez les femmes en âge de procréer et chez les patients « non caucasiens ».
Le document indique aussi comment utiliser ces médicaments dans le contexte actuel de pandémie. Des instructions sont données sur la manière dont les patients prenant des AOD peuvent être vaccinés contre la COVID-19. Comme pour toute injection intramusculaire, les patients doivent simplement se dispenser de la dose matinale de l’AOD le jour de la vaccination, puis reprendre le médicament plus tard dans la journée ou au plus tard le jour suivant.
Des conseils sont enfin donnés pour les modalités d’utilisation des agents de réversion ou « antidotes ». L’utilisation doit en être limitée aux hémorragies menaçant le pronostic vital ou aux hémorragies dans des organes « critiques », par exemple lors d’un traumatisme grave ou d’une hémorragie intracérébrale. A l’inverse, leur utilisation doit être évitée pour les hémorragies mineures telles que les contusions ou les épistaxis.
Steffel J, Collins R, Antz M, Cornu P, Desteghe L, Haeusler KG, Oldgren J, Reinecke H, Roldan-Schilling V, Rowell N, Sinnaeve P, Vanassche T, Potpara T, Camm AJ, Heidbüchel H, Lip GYH, Deneke T, Dagres N, Boriani G, Chao TF, Choi EK, Hills MT, Santos IS, Lane DA, Atar D, Joung B, Cole OM, Field M. 2021 European Heart Rhythm Association Practical Guide on the Use of Non-Vitamin K Antagonist Oral Anticoagulants in Patients with Atrial Fibrillation. Europace 2021
- Résultats à long terme de RACE 3 : Routine Agressive upstream rythm Control for prevention of Early persistent atrial fibrillation
J Taieb, CH Aix en Provence
Étude multicentrique de patients insuffisant cardiaques en FA persistante récente
Après une cardioversion par choc électrique, les patients étaient randomisés dans un bras traitement antiarythmique conventionnel seul (109 patients) ou, complété par une « upstream therapie » comprenant l’association Mineralocorticoide, statines, IEC/ARA2 et rééducation (107 patients). Alors que les résultats à 1 an déjà publiés étaient encourageants sur le maintien en rythme sinusal : RS 75% vs 63% p=0,04, ce n’était pas le cas après un suivi de 5 ans : RS 46% vs 39% NS p=0,34
La discussion a porté sur le suivi qui avait été moins rigoureux après 1 an et le fait que certains facteurs de risques n’avaient pas été pris en compte : Alcool, syndrome d’apnée du sommeil, poids.
Rienstra M. Targeted therapy of underlying conditions in patients with persistent atrial fibrillation and mild to moderate stable heart failure: long term outcome of the RACE 3 trial. Presented at: EHRA 2021. April 23, 2021
- STROKESTOP Trial – D’après la présentation à l’EHRA 2021 par le Dr Emma Svennberg (Karolinska Institut, Stockholm, Suède)
S Boveda, Clinique Pasteur Toulouse
L’étude randomisée STROKESTOP montre qu’un programme de dépistage de la fibrillation auriculaire (FA) dans la population permet d’améliorer le devenir clinique chez les personnes âgées de 75 ou de 76 ans, vivant dans deux régions de Suède. Sur une période de suivi de plus de cinq ans, le risque d’accident vasculaire cérébral ischémique, d’embolie systémique, de mortalité toutes causes confondues, d’accident vasculaire cérébral hémorragique ou d’hospitalisation pour hémorragie était significativement plus faible dans le groupe « dépistage » (HR 0,96 ; P = 0,045). Ainsi, le nombre de personnes qu’il faudrait dépister pour prévenir un événement est de 91.
La question de savoir si le dépistage généralisé de la FA, dans le but de débuter une anticoagulation orale chez les personnes souffrant d’une arythmie jusque-là non-diagnostiquée, afin de réduire leur risque d’accident vasculaire cérébral et de décès est depuis longtemps un sujet d’intérêt.
L’étude STROKESTOP a recruté des patients âgés de 75 et de 76 ans, vivant dans deux régions de Suède (Stockholm et le comté de Halland). Les participants ont ensuite été randomisés pour être invités ou non au dépistage de la FA. Le suivi a ensuite été effectué pendant un minimum de 5 ans à l’aide des registres nationaux suédois.
L’étude a porté sur 13 979 personnes randomisées dans le bras « dépistage » et 13 996 dans le groupe « témoin » (âge moyen 76 ans ; 55% de femmes). Dans le groupe de dépistage, les personnes sans diagnostic préalable de FA ont bénéficié d’enregistrements ECG deux fois par jour pendant deux semaines. Un suivi systématique a été organisé pour les patients dont la FA venait d’être détectée et pour ceux dont le diagnostic était déjà établi et qui n’étaient pas encore traités par anticoagulation orale.
Environ la moitié des participants invités à participer au dépistage (51,3 %) l’ont effectivement fait, et ces personnes tendaient à présenter un risque plus faible que celles qui n’ont pas répondu à l’invitation. Ce sous-groupe plus compliant était toutefois en moyenne légèrement plus jeune, avait un score moyen CHA2DS2-VASc plus faible et présentait moins de comorbidités.
La proportion de personnes ayant reçu un diagnostic de FA au cours du suivi a augmenté de 12,1 % à 14,0 % dans le groupe « dépistage », alors qu’il n’y a eu aucun changement dans le groupe témoin (le pourcentage est resté autour de 12,8 %).
En ce qui concerne le critère principal de bénéfice clinique net, il y a eu moins d’événements dans le groupe de dépistage (4 456 contre 4 616), ce qui indique une « différence faible mais néanmoins significative entre les 2 groupes, en faveur du dépistage », selon le Dr Svennberg. Les taux d’événements globaux étaient plus faibles que prévu, mais les courbes ont commencé à se séparer entre le groupe dépistage et le groupe témoin après 4 ans, ce qui indique que les effets à long terme pourraient être d’autant plus pertinents…
Une analyse selon le traitement indique que la différence d’évènements est due à une réduction du nombre d’accidents ischémiques cérébraux chez les participants qui ont subi un dépistage par rapport à ceux du groupe témoin (HR 0,76 ; 95% CI 0,68-0,87). Les personnes invitées à se soumettre à un dépistage mais qui ne l’ont pas fait présentaient le risque le plus élevé d’AVC ischémique.
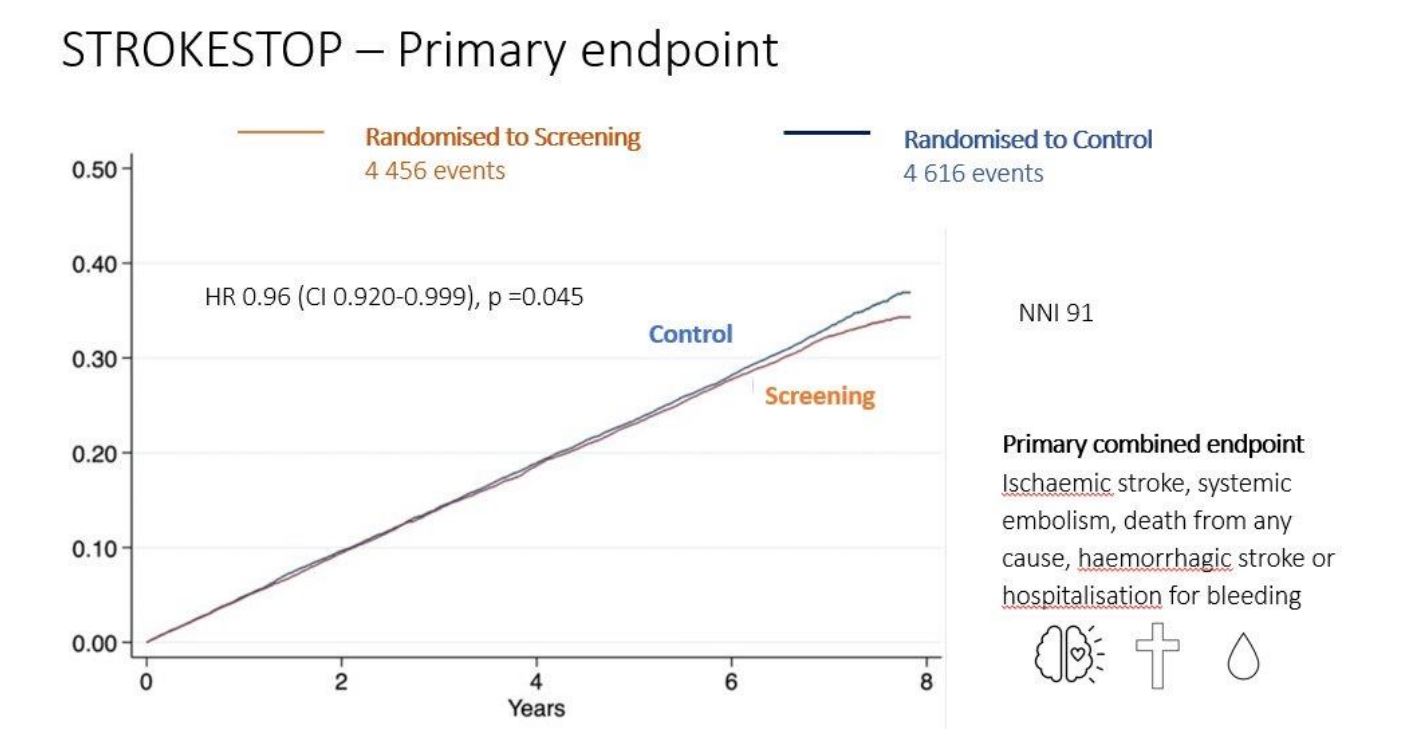
Ainsi, STROKESTOP est l’une des premières études à montrer un bénéfice du dépistage de la FA, ce qui vient renforcer les dernières recommandations européennes qui donnent une recommandation de classe I pour le dépistage opportuniste de la FA (par prise de pouls) chez les personnes de 65 ans et plus.
Svennberg E. Benefits of systematic screening for atrial fibrillation – the STROKESTOP study. Presented at: EHRA 2021. April 23, 2021
- Quelle explication aux résultats de l’étude EAST-AFNET 4 en faveur du contrôle précoce du rythme dans la prise en charge de la fibrillation atriale ?
J Mansourati, CHU Brest
Au cours de la session Late Breaking Trials du congrès EHRA 2021, Andreas Metzner (Hambourg, Allemagne) a tenté d’analyser les résultats de l’étude EAST-AFNET 4 présentée préalablement à l’ESC en septembre 2020 et publiée le 1er octobre 2020 par P Kirchhof et al dans le New England Journal of Medicine.
Cette étude réalisée dans 135 centres internationaux a inclus 2789 patients avec une fibrillation atriale (FA) de diagnostic récent (moins d’un an, médiane de 36 jours) qui ont été randomisés en deux groupe : un groupe de « contrôle précoce du rythme cardiaque » par un traitement antiarythmique ou une ablation de la FA et un groupe de « prise en charge habituelle » en fonction des symptômes. L’objectif principal de l’étude était composite : mortalité cardiovasculaire, AVC ou hospitalisation pour aggravation d’une insuffisance cardiaque ou un syndrome coronaire aigu. L’objectif secondaire était le nombre de nuits d’hospitalisation par an. Dans l’analyse des critères primaires de sécurité, avaient été inclus le décès, l’AVC et les événements indésirables sérieux en rapport avec le traitement antiarythmique. Les critères secondaires étaient les symptômes et la fonction ventriculaire gauche.
L’étude avait été arrêtée après une durée médiane de suivi de 5,1 ans. Un événement de l’objectif primaire est survenu moins souvent dans le groupe « prise en charge précoce du rythme » (HR 0,79 ; IC 96%,0,66-0,94 ; p=0,005). Le nombre de nuits d’hospitalisation n’était pas significativement différent entre les 2 groupes (5,8±21,9 et 5,1±15,5 par an, p=0,23). Il n’y avait pas de différence significative dans la survenue d’événement indésirable du critère primaire de sécurité entre les deux groupes mais les événements indésirables sérieux en rapport avec le traitement de l’arythmie sont survenus chez 4,9% du groupe contrôle précoce contre 1,4% du groupe contrôle en fonction des symptômes. A 2 ans, les symptômes et la fonction ventriculaire gauche ne différaient pas entre les 2 groupes.
Une analyse plus approfondie des deux groupes, présentée à EHRA 2021, ne retrouvait pas de différence dans le traitement anticoagulant (plus de 90% des patients dans les 2 groupes avec plus de 50% des patients sous AOD), le contrôle de la fréquence cardiaque, le traitement antihypertenseur (contrôle similaire dans les deux groupes), l’insuffisance cardiaque ni la présence d’un diabète. Les IEC, ARAII ou antialdostérone étaient prescrits chez 70% des patients. Les patients ayant des antiarythmiques étaient revus un peu plus souvent dans le but d’ajuster le traitement au début du suivi après la randomisation. La plupart des patients (80% environ) étaient sous traitement bradycardisant de façon similaire dans les deux groupes avec une tendance vers une diminution de leur utilisation dans le groupe contrôle précoce du rythme. Le recours à l’ablation dépendait de la disponibilité de la technique dans le centre investigateur. Il n’y avait donc pas d’explication claire à la différence retrouvée entre les 2 groupes.
La discussion des résultats par Nikolaos Dagres (Leipzig, Allemagne) a tourné autour de plusieurs points :
- L’étude montre une diminution de l’objectif primaire mais pas de la mortalité totale ni la qualité de vie
- Les patients inclus dans le groupe « prise en charge précoce » étaient asymptomatiques ou en rythme sinusal au moment de la randomisation ce qui ne correspond pas à la prise en charge des patients en routine.
- Une transmission de l’ECG était plus régulière chez les patients du groupe « prise en charge précoce », ce qui pourrait avoir un effet favorable chez les patients impliqués de façon plus active.
- L’effet sur la mortalité n’est pas encore résolu et pourrait être différent sur une plus grande population.
- Aux 2 questions les patients vivront-ils mieux ou vivront-ils plus longtemps, il semble ressortir de cette étude que les patients vivront peut-être plus longtemps (19% de diminution relative mais non significative de la mortalité dans le groupe prise en charge précoce) mais pas mieux. L’effet sur la mortalité reste tout de même à démontrer dans une plus grande population
- Recommandations EHRA sur la stimulation cardiaque et la resynchronisation
G Laurent, CHU Dijon
Les recommandations EHRA sur la stimulation cardiaque et la resynchronisation ont été établies cette année en collaboration avec les groupes d’experts de rythmologie et d’insuffisance cardiaque ce qui a permis d’obtenir un document consensuel contrairement à celles publiées séparément en 2013 et 2016.
Les nouveaux traitements de l’insuffisance cardiaque comme les inhibiteurs de la SGLT2, les inhibiteurs des récepteurs de l’angiotensine et de la Néprilysine (ARNI), et bientôt peut être certains agents myotropes (Omecamtiv Mecardil) ne font pas (encore) partis du « traitement médical optimisé » recommandé avant l’implantation d’un resynchronisateur. La discussion a porté sur le suivi qui avait été moins rigoureux après 1 an et le fait que certains facteurs de risques n’avaient pas été pris en compte : Alcool, syndrome d’apnée du sommeil, poids.
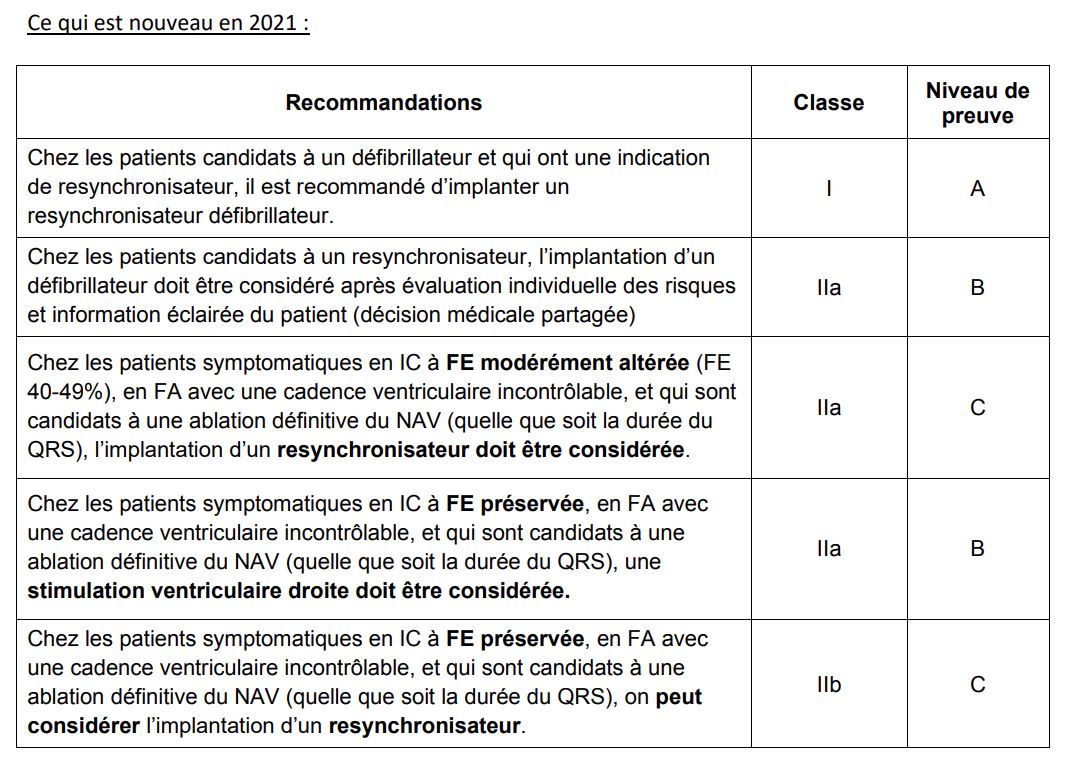


La stimulation Hisienne est une alternative physiologique à la stimulation VD et CRT, cependant il y a encore assez peu d’informations concernant la sécurité de ce système et les performances à long terme. L’EHRA estime qu’il n’y a pas assez d’études comparatives randomisées et contrôlées avec le CRT, pour éditer des recommandations de première intention de niveau I ou IIa. La mise en place d’une sonde ventriculaire droite de sécurité présente certains désavantages vis-à-vis de la technique (plus de sondes implantées donc un cout supplémentaire et plus de risque à l’implantation, une programmation plus compliquée sur des boitiers non dédiés).
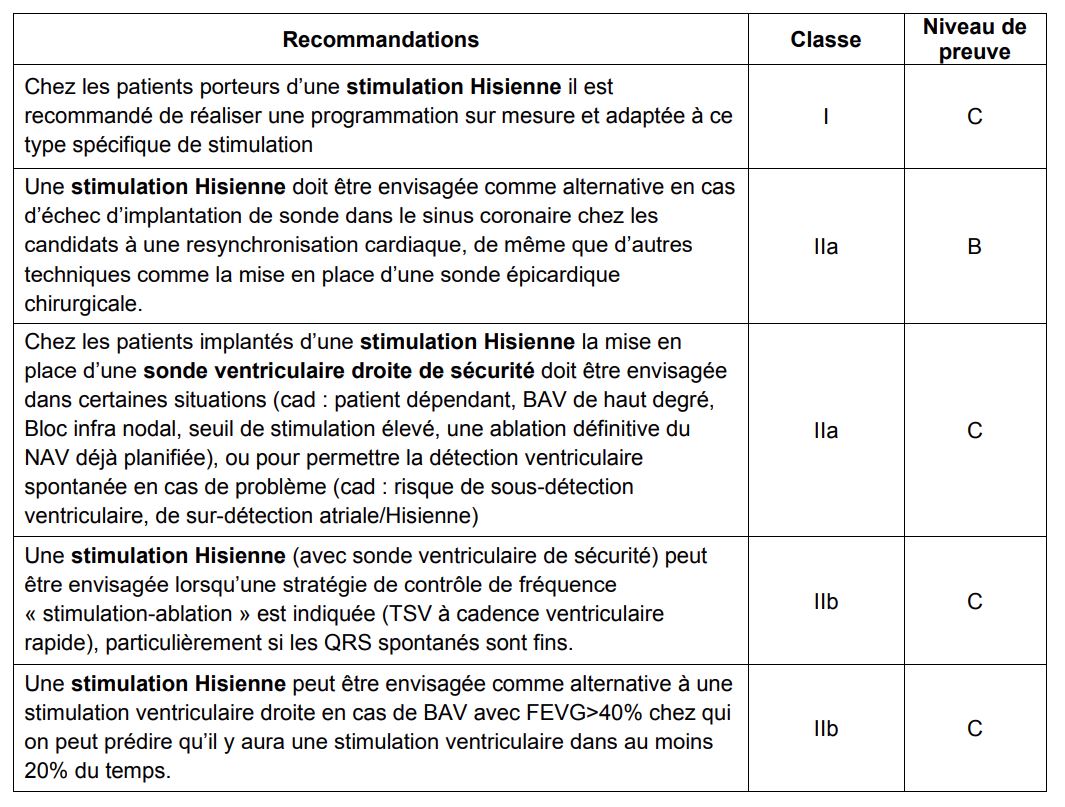
Les données actuelles concernant la stimulation dans la « zone » de la branche gauche ne sont pas suffisantes pour éditer des recommandations. Néanmoins cette technique peut avoir certains avantages par rapport à la stimulation Hisienne : la zone à capturer est plus large et donc le positionnement de la sonde est plus facile, les seuils sont meilleurs et plus stables, il n’y a donc pas besoin de stimulation de sécurité et il n’y a pas de risque à réaliser une ablation définitive du NAV.
2021 ESC Guidelines on cardiac pacing and cardiac resynchronisation therapy
- Session sur le consensus d’expert EHRA sur techniques conventionnelles d’implantation PM/DAI
Pascal Defaye, CHU Grenoble Alpes
Une session importante a été consacrée au consensus d’expert EHRA sur les techniques optimales d’implantation conventionnelle des stimulateurs et défibrillateurs. Ce consensus d’expert a été publié en ligne dans Europace le 21 avril 2021. Il est également approuvé par les HRS, AP-HRS et LA-HRS, consensus presque mondial donc !!
Il a été codirigé par Haran Burri (Genève) et Christoph Starck (Berlin).
Mauro Biffi de Bologne en a, d’abord, détaillé les objectifs. Ce consensus d’expert part du principe que les techniques d’implantations ont été un peu délaissées ces 20 dernières années avec le développement de toutes les autres techniques interventionnelles comme l’ablation alors qu’il s’agit de la base de notre métier.
Il faut remettre en avant les techniques d’implantations conventionnelles car ce n’est pas si simple et elles doivent être hyper-rigoureuses.
Ces techniques associent l’acquisition de techniques endocavitaires ainsi qu’un apprentissage chirurgical. Elles sont vraiment fondamentales dans la formation d’un rythmologue interventionnel. Certaines études montrent qu’uniquement 60 % des sondes de DAI sont fonctionnelles à 10 ans et on peut penser que l’influence des techniques d’implantation est majeure dans la performance à long terme de ces sondes. En quelques sorte la plupart des complications sont liées à une formation inappropriée des opérateurs.
Ce consensus est très agréable à lire et permet, en ligne, de visualiser des vidéos sur les techniques ainsi que des conseils et astuces afin d’éviter les complications et préserver le long terme. Des « tutorials » sont en ligne pour optimiser les étapes de l’implantation des sondes aussi bien sur le plan chirurgical que sur le plan de la radiologie.
Un des buts est également de définir des objectifs et des mesures de performance pour une implantation de bonne qualité. Mais, il ne décrit que ce qu’on appelle la stimulation et la défibrillation « conventionnelle » en excluant donc la resynchronisation cardiaque.
Certaines positions sont tranchées et auraient méritées plus de discussion et paraissent plus se référer à l’opinion du rédacteur qu’un consensus d’expert. Des détails sont surprenants ; un exemple : la notion d’implantation de sonde double coil de défibrillation est décrite en cas d’abord droit ce qui parait, pour le moins, discutable.
La question des accès veineux a été développé par Haran Burri de Genève.
L’accès veineux céphalique est privilégié à nouveau et c’est important. Il faut vraiment que l’apprentissage de l’implantation passe par la dénudation céphalique. On ne doit pas, par facilité, apprendre uniquement la voie sous clavière, elle est à pratiquer en seconde intention. Des vidéos complémentaires sont en ligne et peuvent aider à progresser
La possibilité de ponction axillaire a été développé, probablement un peu en excès, car c’est la technique de choix d’Haran Burri. Je ne suis pas certain qu’il s’agisse d’une technique indispensable, notamment, quand on est totalement initié aux voies céphaliques et sous clavière en deuxième intention.
Ce chapitre se termine par un consensus de choix avec des classes d’évidence (cœur vert à cœur rouge) mettant la ponction axillaire ou la dénudation céphalique en premier choix (dans l’ordre de citation ponction axillaire !!). C’est, encore une fois, à mon sens vraiment discutable. En tout cas, la ponction axillaire en première intention est très centre dépendant et ne parait pas ce que l’on conseille dans la plupart des grands centres en France.
Un certain nombre de propositions sont également décrites pour faciliter l’implantation, notamment les techniques permettant de franchir les sténoses et thromboses.
Carsten Israël de Bielefeld en Allemagne a ensuite détaillé le consensus sur la position des sondes. D’emblée, il a insisté sur la nécessité en 2021 de mettre en place des sondes actives dans l’OD et le VD ce qui permet de choisir la position des sondes, de diminuer le risque de déplacement et également de perforation.
Quand on veut confirmer une bonne position de sonde, on doit les visualiser en incidence antéro-postérieur (Face) et également en OAG. Cela permet d’affiner et de confirmer les positions septales notamment.
Il faut également bien connaitre la sonde implantée et notamment les aspects radiologiques permettant de confirmer que la vis est sortie et donc vissée. Ces marqueurs radiologiques varient même, selon les modèles, pour une même marque. Il faut également bien enregistrer les courants de lésion prouvant la bonne fixation des sondes.
Par contre, il n’y a pas de recommandations formelles dans ce consensus sur la position des sondes elle-même car il n’y a pas d’évidence irréfutable, notamment dans les discussions VD apex, VD septum ou VD mid-septum. C. Israel suggère quand même que la position mid-septale est la meilleure avec une hémodynamique optimisée et un risque moindre de perforation.
A nouveau, un certain nombre d’astuces sont données pour éviter les placements involontaires des sondes dans le ventricule gauche ou dans des branches du sinus coronaire avec de beaux exemples à ne pas reproduire.
Sur le plan atrial, des conseils sont également donnés de privilégier, en premier lieu, l’auricule droit ? Cela, à mon sens, doit être discuté car, avec les sondes actives, d’autres positions sont possibles et l’auricule n’est plus pour nous la place de choix. Il semble que certains conseils paraissent être très dépendant du choix du rédacteur qui va défendre sa technique plutôt qu’un consensus d’experts.
Christoph Starck a finalement développé la prévention et le traitement des complications en stimulation cardiaque et défibrillation implantable en développant les 4 types de complications principales : les perforations, le pneumothorax, les hématomes de poche et l’infection.
Certains facteurs favorisent le risque de perforation, notamment le statut des patients : patientes âgées et de faible IMC sous traitement corticoïde et antiagrégant. La plupart des perforations sont asymptomatiques mais elles peuvent entrainer des tamponnades dans 1,5% des cas.
Le pneumothorax est généralement évité par une bonne technique d’implantation. Il faut être très large sur le drainage hormis pour les pneumothorax très limités apicaux.
Le problème des hématomes est fréquent notamment en cas de traitement anticoagulant avec des conseils de ne pas interrompre le traitement anticoagulant et ne pas effectuer de relai. Certains hématomes de poches doivent être traités de façon conservative. On rappelle la contre-indication absolue, bien sûr, à la ponction d’hématome. Enfin, un certain nombre de recommandations sont données pour réduire le risque d’infection.
On peut dire comme « take home messages » que la formation des opérateurs est d’une importance majeure pour diminuer et éviter les complications et qu’un opérateur doit savoir traiter les complications de façon optimale.
Une discussion entre les orateurs suit la présentation de ce consensus d’expert. Cette discussion met en avant l’importance majeure dans la formation d’un rythmologue d’obtenir la qualité optimale dans l’implantation des systèmes conventionnels de stimulation cardiaque, et défibrillateur, simple ou double chambre. C’est la base de notre métier et malgré le développement de la stimulation sans sonde et du Défibrillateur sous cutané, les techniques d’implantation conventionnelles sont la base de notre métier et ne vont pas disparaître. Les sondes sont, à priori, implantées « à vie », on doit donc apprendre à respecter des critères de qualité. Cela va permettre d’optimiser la longévité des systèmes et de réduire le risque de complications.
Haran Burri, (Chair), and al, EHRA expert consensus statement and practical guide on optimal implantation technique for conventional pacemakers and implantable cardioverter-defibrillators: endorsed by the Heart Rhythm Society (HRS), the Asia Pacific Heart Rhythm Society (APHRS), and the Latin-American Heart Rhythm Society (LAHRS), EP Europace, 2021;, euaa367, https://doi.org/10.1093/europace/euaa367
HISTOIRE ET TEMOIGNAGE
Michel Chauvin, Institut de Cardiologie de Strasbourg
On ne compte plus les recherches conduites dans des lieux insolites : les garages ont souvent la faveur de nos professeurs Nimbus, la table de la cuisine ou la Caisse d’Épargne sont plus rares, mais la gare ferroviaire désaffectée reste l’exception. C’est pourtant celle-ci que choisit Norman Jeff Holter, ce chercheur qui, suprême récompense, a vu son patronyme devenir… un nom commun ! Il est habituel d’illustrer les recherches de Holter par cette photo de 1947 où on le découvre à la peine sur une bicyclette ergométrique, chargé d’un fardeau d’environ 43 kilos censé́être le tout premier « holter ». L’effet sur le lecteur est garanti ; la vérité est tout autre.
Holter n’est pas médecin mais physicien et chimiste. C’est à l’Université́de Californie qu’il est amené́ à collaborer dans un laboratoire où l’on cherche comment recueillir à distance des signaux électriques générés par l’organisme humain. Le but est de faciliter des travaux de Physiologie en s’affranchissant de câbles d’enregistrement. Holter fonde pour ce faire la Holter Research Foundation sur ses fonds propres, et comme il lui faut un local, il ne trouve pas mieux qu’une gare désaffectée.
À cette époque on s’intéresse beaucoup à l’électro-encéphalogramme. C’est donc tout naturellement qu’Holter oriente ses premières recherches sur son recueil à distance. Il commence par adjoindre à l’enregistreur habituel un émetteur radio chargé de transmettre les signaux vers un récepteur à tube cathodique. Ça parait simple, mais les résultats sont mitigés en raison de la trop faible amplitude des signaux électriques. Que choisir qui soit plus adapté à ce genre de technique ? Le cœur, qui génère des signaux beaucoup plus voltés. Holter en fait son nouveau sujet d’expérience. Il s’équipe ainsi d’un électrocardiographe habituel qu’il transporte dans une sorte de sac-à-dos. Son propre ECG est alors transféré vers un émetteur (toujours dans le sac-àdos) qui le transmet à son tour par radio vers le même récepteur à tube cathodique décrit plus haut. On est bien loin des circuits transistorisés et des batteries au lithium que l’on connaît aujourd’hui : c’est volumineux, lourd, et l’air pas-du-tout-à-l’aise de Holter sur sa bicyclette ergométrique le confirme… Mais le résultat n’est pas si mal : le « radio-électrocardiogramme » (sic) qui défile sur l’écran « ressemble assez à un ECG ordinaire » (re-sic). Pour preuve, Mc Innis le teste en 1952 chez un coronarien et parvient à distinguer ce qui ressemble à une onde Q d’infarctus… Conclusion : « la seule application envisageable à ce dispositif est de visualiser une éventuelle modification de ST-T au cours d’une épreuve d’effort » !

Mais l’obligation de n’utiliser cette transmission que dans une zone très restreinte autour du récepteur ne satisfait pas Holter. Comment parvenir à augmenter ce périmètre lorsque la technique utilisée ne le permet pas ? Holter trouve la solution : il faut une étape intermédiaire, et cette étape consiste à différer la transmission de l’ECG vers le récepteur cathodique. Comment y parvenir ? Tout simplement en l’enregistrant sur bande magnétique dont on examinera le contenu plus tard. On se rapproche du système actuel, d’autant que les transistors ont fait leur apparition, permettant de miniaturiser un premier enregistreur ECG que le patient transporte dans une petite valise… qui contient aussi un enregistreur sur bande magnétique. Le transport s’en trouve considérablement facilité. L’enregistrement est lu dans un second temps à vitesse accélérée sur un volumineux lecteur à tube cathodique.
Le « Holter » est né, et grâce à l’évolution de l’électronique, l’ensemble du système est bientôt confiné dans un seul étui portatif d’environ 1 Kg. Reste à le développer et le commercialiser. Holter présente son invention… à un fournisseur de matériel aéronautique qui s’en chargera en le faisant évoluer, en le miniaturisant plus encore pour finalement le commercialiser sous la marque Avionics.
L’objectif des premières recherches de Holter a été dépassé pour permettre d’aboutir à ce dispositif devenu incontournable aujourd’hui. Ce sont les aléas de la Recherche, quitte à revenir sur l’affirmation malicieuse du Général De Gaulle : « Des chercheurs qui cherchent, on trouve, des chercheurs qui trouvent… on cherche ! »
